進行膵臓がん患者に対する第II相臨床試験開始のお知らせ
「有効な治療法のない進行膵臓がん患者に対するサバイビン2Bペプチド・インターフェロン併用療法の第II相臨床試験」の開始のお知らせ
<概 要>
このたび、札幌医科大学附属病院における医師主導型治験となる「有効な治療法のない進行膵臓がん患者に対するサバイビン2Bペプチド・インターフェロン併用療法の第II相臨床試験」を実施することとなりましたのでお知らせいたします。
医学部病理学第一講座 佐藤 昇志教授及び附属病院第1外科平田公一教授を中心とする研究グループは、H24.9-H25.5に実施したサバイビン2Bワクチン第1相試験の結果をもとに、有効な治療法のない進行膵臓がん患者を対象に、インターフェロンを併用したがんペプチドワクチン「サバイビン2B」の有効性を確かめるための医師主導型治験を、10月16日より開始いたしました。
なお、本治験は厚生労働科学研究費補助金事業として、東京大学医科学研究所病院と共同で実施されます。
札幌医科大学では、1980年代よりヒトがん抗原の同定、ヒト免疫応答の分子機構解明、ヒト固形腫瘍のがん幹細胞抗原の同定等の研究を精力的に進めており、その中でサバイビン2Bが発見されました。
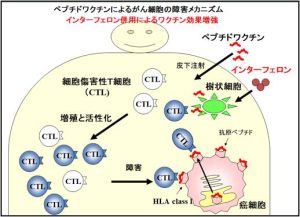
サバイビン2B(SVN-2B)は、がん抗原タンパク質を小さく断片化した分子(ペプチド)の一種です。サバイビンはがん細胞において強く発現しており、サバイビン2Bを皮下注射することで、このペプチドが患者さんの体内でリンパ球を刺激して増加、活性化させ、がん細胞を識別、攻撃して死滅させると考えられています。H24.9-H25.5に札幌医科大学附属病院で実施した第1相試験では、約53%の症例で腫瘍の増大を抑制する効果が確認されました。
今回の試験では「STI-01」というインターフェロン ベータ製剤を併用します。インターフェロンは樹状細胞と呼ばれるリンパ球の教育係に相当する細胞を活性化する作用がありますので、サバイビン2Bペプチドのリンパ球刺激効果を高めるために皮下注射します。平成16年2月より実施された臨床試験では、ペプチドとインターフェロンアルファを併用投与することによって、ペプチドだけを投与するより、腫瘍抑制効果および免疫学的効果が高くなる可能性があることが確認されました。今回の治験では、アルファ型と効果がほぼ同じであるといわれているベータ型のインターフェロンを併用投与し、腫瘍抑制効果、免疫学的効果、安全性を確認することとしました。
治験の概要
目的:サバイビン2Bペプチド単独投与およびインターフェロン併用投与の治療効果と安全性の確認
実施機関:札幌医科大学附属病院第1外科、東京大学医科学研究所附属病院外科
自ら治験を実施する者:札幌医科大学附属病院第1外科 准教授 水口みずぐち 徹とおる
実施期間:2013年10月~2016年12月(登録期間:24ヵ月)。
予定症例数:71例
対象疾患:膵臓がん(進行再発膵管がん)
対象患者:
- 組織学的に上記の対象疾患と確定診断され腫瘍細胞にサバイビンが発現していること
- 根治手術が不可能で既に標準的抗がん剤治療(ジェムザールまたはTS-1)をうけていること
- 過去にがんワクチンの治療を受けていないこと
- HLA遺伝子がHLA-A*2402であること
- 同意取得時の年齢が20~85歳であること等の基準をすべて満たし、当該治験への参加に同意した患者さんを被験者とします。
※基準の詳細につきましては、下記問い合わせ先まで、お問い合わせください。
投与方法およびスケジュール:
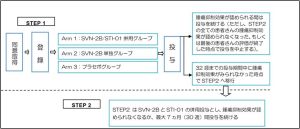
STEP1では、患者さんは、①ペプチド・インターフェロン併用群、②ペプチド単独群、③プラセボ群、の3グループにランダムに振り分けられます。患者さんも医師も、どの群に振り分けられたのかを知ることはできません。
最初の8週間は毎週1回インターフェロンを腹部皮下に注射し、2週間毎に同じ部位にペプチドと免疫補助剤を混合した乳化剤を注射します。ペプチド計4回の投与が終了した2週間後に第1回目の効果確認検査(CTおよびMRI検査)を実施します。腫瘍抑制効果が確認されれば、その後も2週間毎にインターフェロンとペプチド乳化剤の投与を継続し、6週間毎に効果確認検査(CT検査)を実施します。腫瘍の進行が認められた場合は、患者さんの希望によりSTEP2へ移行します。STEP2では、STEP1のグループに関係なく全員がインターフェロンとペプチドの併用投与を受けることができます。STEP1と同様のスケジュールで効果確認検査を実施します。
考えられる副作用:
これまでの臨床試験から、発熱や全身倦怠感などの感冒様症状が認められることがあります。また、ペプチド乳化剤を接種した部位に硬結・掻痒感、皮下出血、紅斑が認められることがあります。そのほかにインタフェロンベータの副作用として、頭痛・頭重、悪寒、白血球減少、血小板減少、肝機能異常等が報告されています。この他にも予測不可能な副作用が起きる可能性は否定できません。
基礎研究の成果を医薬品として実用化することで広く国民に還元すべく、平成23年度から厚生労働科学研究費補助金「難治・がん等の疾患分野の医療の実用化研究事業」に採択され、北海道臨床開発機構の支援のもと、今年度初めに第1相試験を終了いたしました。今回さらに、東大医科学研究所附属病院および国立がん研究センターの支援を受けて、第2相試験を開始することができました。今後この治験の結果を受けて、製薬企業と連携し、速やかな製剤化を目指したいと考えています。