関節リウマチ(rheumatoid arthritis; RA)とは
関節リウマチ (RA) は,末梢関節を中心とした多関節の滑膜炎と,それによる関節破壊を特徴とする自己免疫疾患です.有病率は約1%とされており,女性患者が男性患者の約2倍とされる最多の古典的膠原病の一つです1).関節破壊が日常生活動作を障害するだけではなく,時に関節外症状を伴い間質性肺炎,血管炎などの全身的な症状を合併することもあります.数多くの生物学的製剤やJAK阻害薬を含む抗リウマチ薬の開発により,予後やQOLは改善が見込めるようになったものの,治癒は難しく,また生命予後も健常人と同等とは言えず,個人・社会・国家的な損失となっています.
RAの治療は,従来型抗リウマチ薬と生物学的製剤・JAK阻害薬を用いた治療により大きな変化を遂げており,リウマチ専門医以外には理解が追い付かないこともしばしばとなってきてしまっています.このページはRAの基本についてリウマチ専門医以外の先生の理解を深めるために編集してあります.
RAの病態生理
多様な生物学的製剤に対する治療反応性が患者毎に異なる点,またRAの病状・予後も患者毎に異なる点,病態に関する研究でも様々な異なるメカニズムが報告されていることなどから,RAは異なる病態背景から起こる共通の臨床的特徴を持った症候群であるとされるようになってきています.
RAの共通の特徴として,関節滑膜炎があります.健常な滑膜は薄い細胞層からなり,滑液(関節液)を産生し,関節運動時の潤滑油として働いたり関節軟骨の栄養を担ったりします.RAではその滑膜に炎症が起こり,細胞浸潤・血管新生・滑膜線維芽細胞の増生がおこり,パンヌスと呼ばれる増殖組織がみられるようになります.滑膜病理組織像上は炎症相により炎症細胞浸潤の程度も異なることがありますが,時に胚中心性B細胞を含むリンパ濾胞が形成されるような高度の炎症細胞浸潤を伴う場合もあります.これらの滑膜炎には自己免疫応答に関与していると考えられています.RAの滑膜炎においては滑膜線維芽細胞やT細胞が分泌するreceptor
activator of nuclear factor-kappa B ligand (RANKL)により破骨細胞が活性化され骨吸収が生じることで,RAに特徴的な骨びらん,骨破壊が生じるとされます.また,マクロファージや滑膜線維芽細胞などが産生するmatrix
metalloproteinases (MMP)などの蛋白分解酵素は骨・軟骨破壊を助長します.その他にも線維芽細胞の増殖,炎症細胞の活性化などが複合的に作用し,RAの病態が起こるとされています.特に,tumor
necrosis factor alpha (TNF-α),interleukin 6(IL-6)などの炎症性サイトカインが病態形成に重要な役割を果たしているとされ,それらの阻害が高い治療効果を示しています.
これらのRAに特徴的な病態が起こる原因は個々人により異なるとされ,様々な遺伝的要因・環境的要因,自己抗体などの関与が示唆されています.ここからそれらについてもう少し詳細に説明します.
RAの遺伝的要因
一卵性双生児でのRAの発症一致率は12~15%,二卵性双生児や兄弟での一致率は2~4%とされており2),RAは遺伝的要因だけではなく環境要因も発症に関与すると考えられています.遺伝的要因のうち,最も強い関連があるのはヒトMHCクラスⅡ分子であるHLA-DR遺伝子であり,遺伝的要因の約50~60%を占めるとされています.中でもHLA-DRのβ鎖をコードするHLA-DRB1遺伝子多型が最も重要とされています.RAに関連するHLA-DRB1多型は人種で異なっており,日本人を含む東アジア人では*04:01,*04:04,*01:01が関連します.
これらのHLA-DRB1多型がどのように病態に関与するかも検討されており,これらRA関連HLA-DRB1多型は第70~74残基に類似のアミノ酸配列
(QKRAA,QRRAA,RRRAA) を有しており,この配列はshared epitope (SE) と呼ばれています.SEを持っていると,のちに述べるシトルリン化蛋白を認識する自己抗体
(anti-citrullinated protein antibodies; ACPA)の出現率が高いことも知られており,この抗体の有無は関節破壊の進行に大きな影響があることから,SEはRAの中心となる自己抗体の産生に関与するとされています.さらには,血管炎・肺病変・Felty症候群(好中球減少・脾種を伴うRA)など関節外症状を伴うRAでSEを保有する例が多いと報告されています3).
HLA以外の遺伝子に関しては,近年のゲノムワイド関連解析 (Genome Wide Association Study; GWAS)により,2012年には13の感受性遺伝子が同定され,2014年には同定された感受性遺伝子の数は101に拡大しました4).数多くの遺伝子がRAの発症に関与する可能性が示唆されていますが,これらのGWASで同定された遺伝子がどのようにして病態に関与しているかについてはまだ十分に明らかにはなっていません.
GWASで同定された疾患感受性遺伝子には,例えばタンパクのシトルリン化に関与するPADI4や,抗原提示細胞上の共刺激分子に結合しT細胞へのシグナルを阻害するCTLA4などがあります.特にCTLA4の疾患感受性多型は,可溶性CTLA4の発現量を低下させることで,T細胞が活性化しやすくなるとされています5).CTLA4-IgであるアバタセプトがRA治療に有効であることからCTLA4のRAへの病態への関与が示唆されています.その他ではIL-6受容体遺伝子もRAの疾患感受性遺伝子とされ,感受性多型はCD4陽性T細胞上のIL-6受容体の発現量を増加させ,IL-6下流のシグナル伝達の増強をもたらすとされています6).抗IL-6受容体抗体であるトシリズマブやサリルマブがRAに有効であることからもIL-6受容体とRAの病態への関与も遺伝子から治療までの関連が示されつつあります.その他にもサイトカインシグナルなどに関与する遺伝子群が数多く同定されており,それらの遺伝子異常が個々人の病態に影響を与えていると考えられています.
RAに関与する環境要因としても様々な報告があります.喫煙,歯周病,腸内細菌叢,ビタミンD欠乏,マイクロキメリズムなどが注目されています.
特に,喫煙は気道内のPADIの発現亢進によりシトルリン化蛋白の産生亢進と自然免疫の活性化を介して,抗シトルリン化ペプチド抗体の産生を誘導するとされており,主要なRAの環境要因とされています.先に述べたHLA-DRB1のSEをホモで有する患者に喫煙歴が追加されるとRA発症率が20-40倍になるという報告もあり,遺伝的素因と喫煙も密接に関与しています.重要なことは,禁煙によりRA発病リスクが緩徐に低下していくことも知られていることです.また喫煙はRA治療の反応性をも低下させるといわれており,RAの発症だけではなく,治療経過においても禁煙はきわめて重要な因子となります.その他にも,歯周病の原因菌の一つであるPorphyromonas
gingivalisは自然界に存在する種の中でも珍しく蛋白シトルリン化酵素(PADI)を有し,慢性的な歯周病がシトルリン化蛋白の産生亢進を引き起こすことで,抗シトルリン化ペプチド抗体の産生を誘導するとされています。RAに関連する環境因子の報告はこのほかにも多数存在しますが、これらの環境因子の影響の低減がRAの発症抑制や治療にどの程度有用なのかは,喫煙を除いてはまだはっきりとわかっていません.
RAとACPA
リウマチ因子(RF)は,変性IgGのFc部分に結合するIgM型自己抗体です.RA患者の70~80%で陽性となり,RAの診断上重要な検査所見とされています.しかし,RFはRA以外の様々な疾患でも陽性となるため,診断的特異性は低いとされます.一方で,シトルリン化蛋白を認識する自己抗体
(ACPA) がその診断的有用性や病因との関連性から注目されています.シトルリン化されたタンパク質は多岐にわたるため臨床的にすべてのACPAを同定することは難しいですが,臨床的には人工的に環状化させたシトルリン化ペプチド
(CCP) を抗原に用いた抗CCP抗体が広く利用されるようになっています.抗CCP抗体の感度は,RFとほぼ同等 (60~80%) ですが,特異度が90~95%と高く,RAの臨床経過(関節外病変の出現など)や関節破壊進行の予測因子でもあり,RAの診断とともに治療方針を決める上で極めて重要な検査となっています.ACPAはRA発症の約5年前から検出されるとされ7),RAの免疫異常は関節炎発症前より生じているとされています.
ACPAの出現については多因子の関与がいわれています.双生児のコホート解析では,ACPAの出現については遺伝的因子の関与が2割,環境因子の関与が8割であるとされています8).本邦のながはまコホートでは,喫煙歴のある健常人ではACPA陽性率(>13.5
U/mL)が高く,また,歯周病の重症度とACPA陽性率がよく相関することがしめされています9).この結果は,ACPA産生に喫煙・歯周病などの環境因子が関与していることを示唆しています.その機序として,喫煙がシトルリン化酵素とシトルリン化蛋白の増加を起こすとされ,増えたシトルリン化蛋白がACPA産生を促すと考えられています.また,歯周病の主要な病原菌のひとつであるP. gingivalisはシトルリン化酵素を有しており,P. gingivalisが合成したシトルリン化蛋白がACPA産生を誘導している可能性が考えられています10).
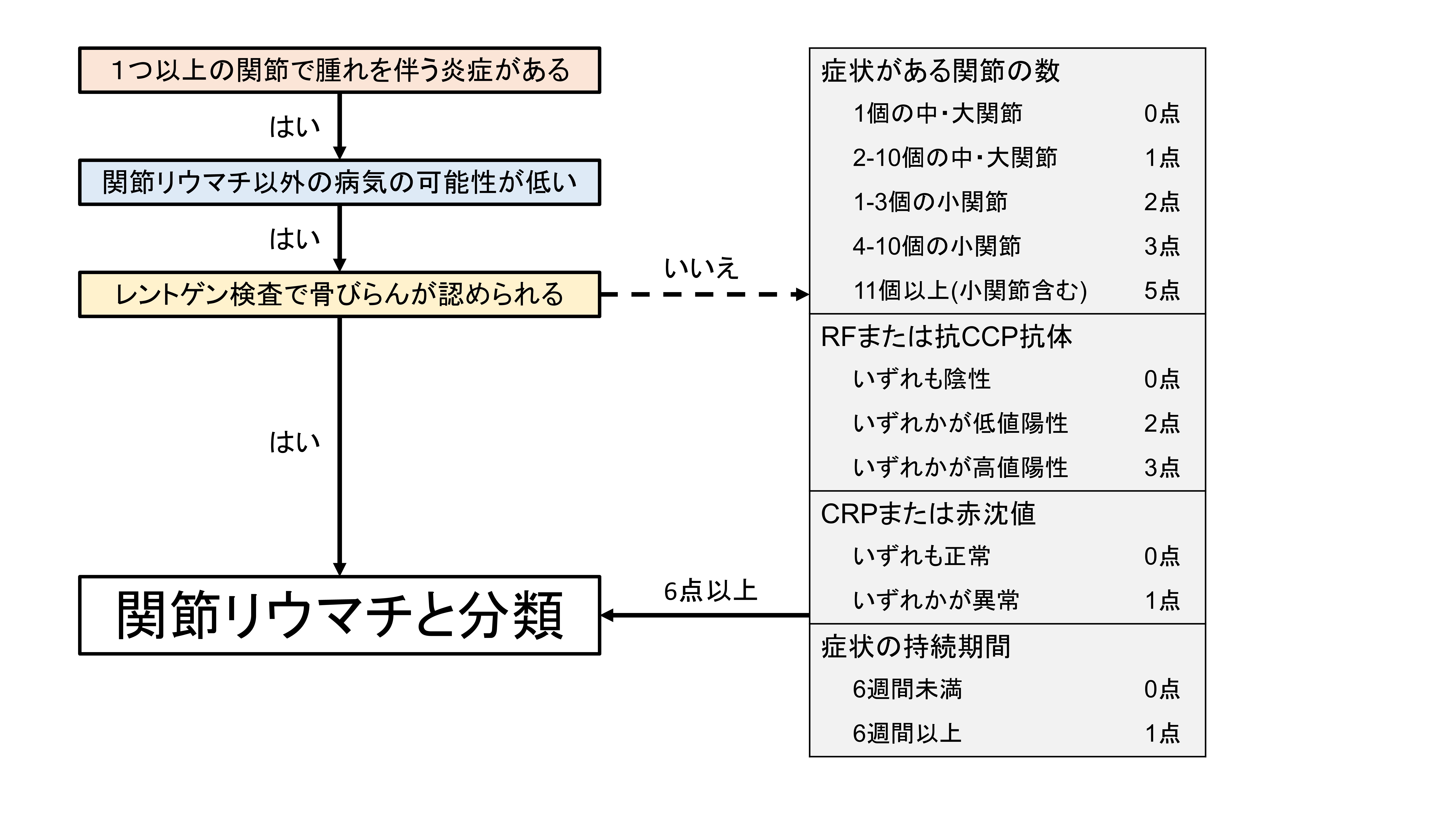
残念ながら、今現在、関節リウマチを確実に診断できる”診断基準”はありません。しかし、実臨床においては、この基準を満たす患者を暫定的に関節リウマチとみなす”分類基準”を用いて、関節リウマチを診断しています。長い間、1987年の米国リウマチ学会による分類基準11)が使われてきました。これは①朝のこわばり、②3領域以上の関節炎、③手関節炎、④対称性関節炎、⑤リウマトイド結節、⑥RF、⑦X線異常所見の7項目のうち4項目以上満たすとき関節リウマチと分類するというもので、除外診断を必要とせず、関節炎診療に習熟していなくても使いやすい基準でしたが、これでは、早期の患者さんを関節リウマチと分類できないことが多く、早期診断には適していませんでした。現在、最も使われているのは2010年に米国および欧州リウマチ学会が合同で作成した新しい分類基準12)で、少なくとも1つ以上の関節で腫れを伴う炎症がみられ、その原因として関節リウマチ以外の病気が認められない場合に、レントゲン検査で骨びらんが認められるとき、または①症状がある関節の数、②RFまたは抗CCP抗体、③CRPまたは赤沈値、④症状の持続期間の4項目についての点数を合計し6点以上であったとき、関節リウマチと分類し、抗リウマチ薬による治療を開始することになっています。ただし関節リウマチ以外の病気でも合計6点以上になってしまうことがあるため、点数をつける前に他の疾患の可能性がないか十分に検討する必要があります。また関節リウマチの人でもこの基準を満たさないことがありますので、疑わしい場合にはMRIや超音波などの画像検査を組み合わせて総合的に判断します。
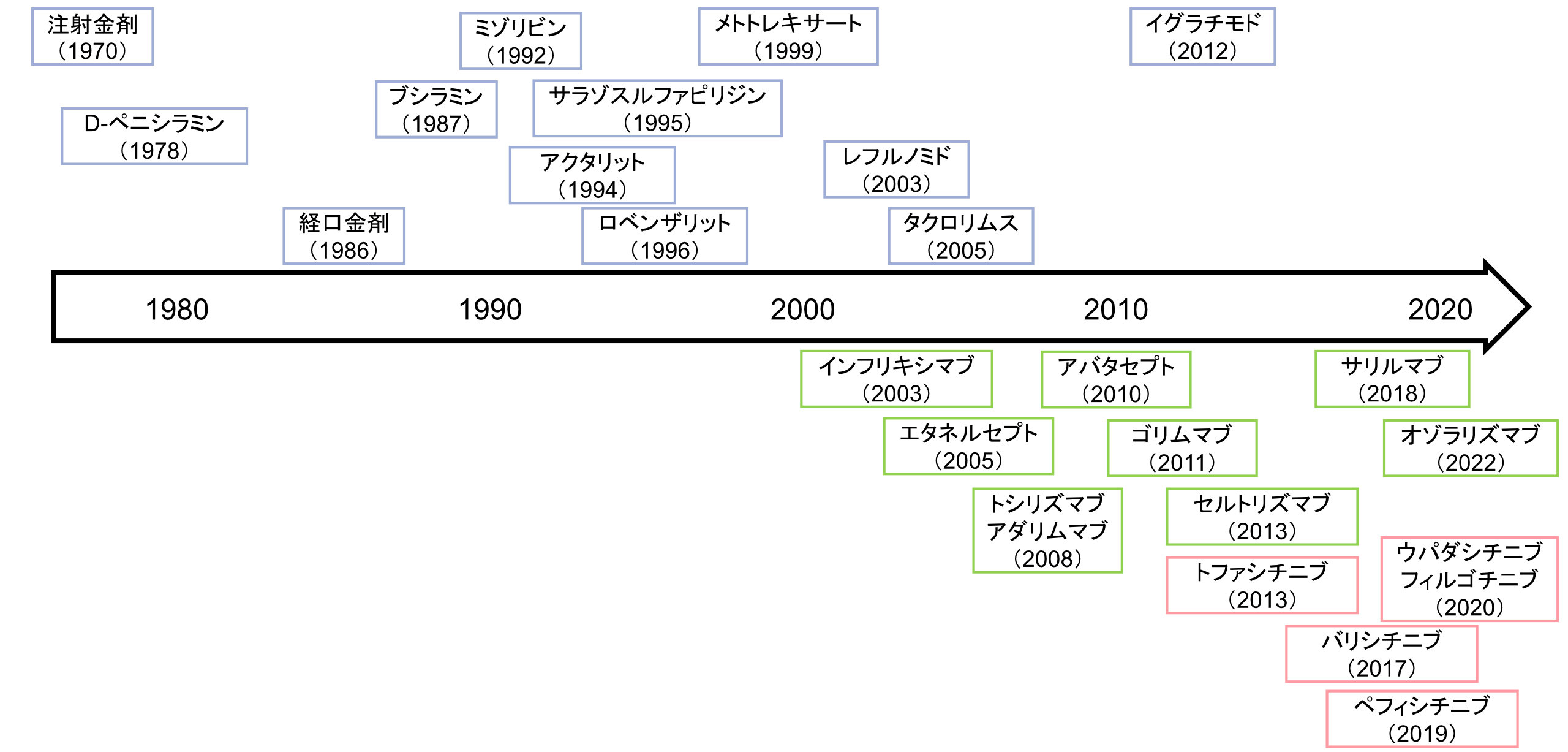
RAの治療には、4つの主要な柱(患者教育・薬物治療・リハビリテーション・手術療法)があります.特に薬物治療は2000年前後から様々な治療選択肢が出現し、大きく変化しています。
RA治療の大原則として重要なことは,RA診断後速やかに抗リウマチ薬(disease modifying anti-rheumatic drugs;
DMARDs)で治療を開始することであり,RA治療は特に早期の治療の質がその後の治療経過・関節予後にとって重要とされています.診断後最初の数年をwindow
of oppotunity(機会の窓)といい、その期間にしっかりと病状をコントロールすることが重要です.
治療に関するガイドラインも本邦・欧州・米国などを中心に定期的に改訂されており,治療に当たってはそれらへの深い理解が重要となってきています.また,治療目標も様々に設定されるようになり,臨床的寛解・構造的寛解・機能的寛解などが提唱されるようになっています.臨床的寛解とは関節痛・関節炎がおおむねコントロールされ関節破壊や身体機能障害の進行がある程度抑制された状態とされ,総合疾患活動性指標であるDAS28,
CDAI, SDAIなどをもちいて評価されるものです.構造的寛解とはX線検査による関節破壊の進行が停止した状態を指し,機能的寛解とは機能障害が起こっていない状態とされます.一般的に後者になればなるほどより高い目標とされ,すべての寛解を目指すことおよび最終的に治療からの離脱などがRA治療の課題となっています.
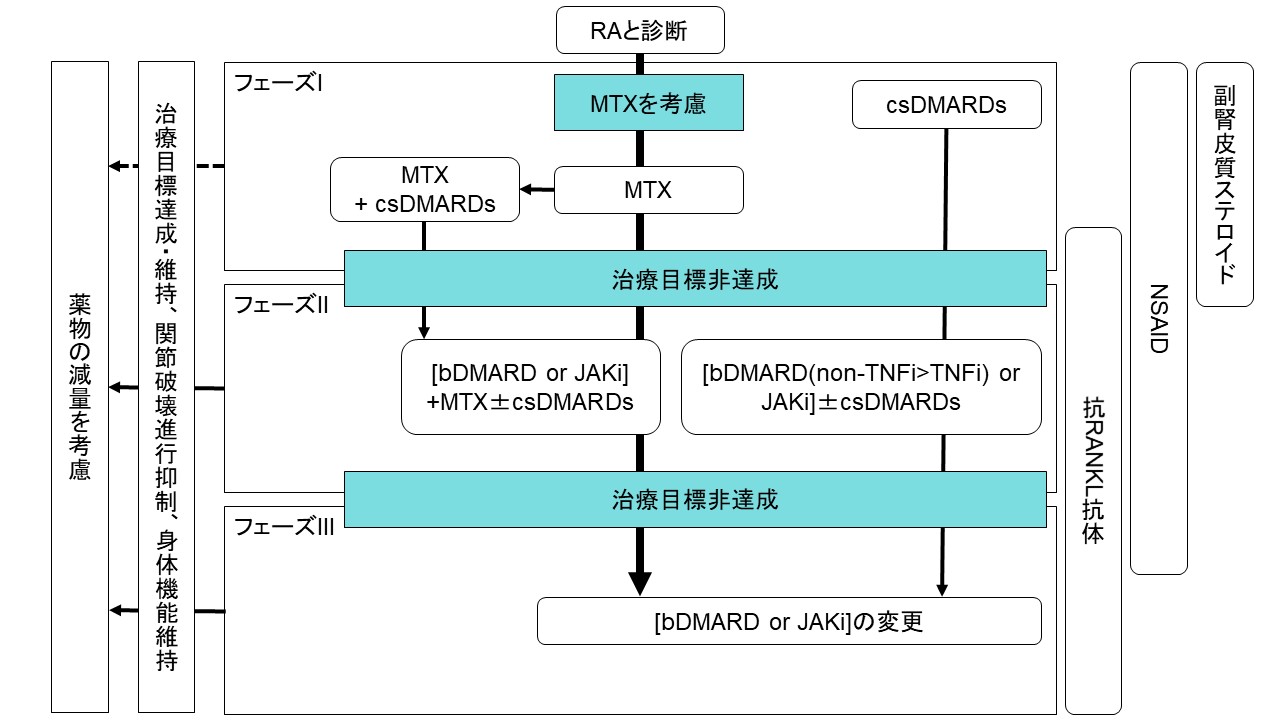
本邦に置けるRA治療のガイドライン13)では,まずRAと診断されたらメトトレキサート(MTX)による治療を考慮し,それが難しい場合には従来型抗リウマチ薬(csDMARDs:上図の青)を用いた治療を行います。これらの治療により3-6か月で治療目標を達成できない場合にはフェーズIIへと移行します。このフェーズでは、生物学的製剤(bDMARDs:上図の緑)やJAK阻害薬(JAKi:上図の赤)の併用を考えていくことになります。フェーズIIでも治療目標が達成できなければフェーズIIIへと移行することになります。
ここまでの内容で感じた方もいらっしゃるかもしれませんが,RAの初期治療は迅速な判断と治療介入が重要であること示されてきており,治療のアルゴリズムに関しても各フェーズの期間がある程度決められており,この時期の治療でもたつくと患者予後に影響することを肝に銘じておく必要があります.
【文献】
1) Smolen JS, et al. The Lancet 388(10055): 2023-38, 2016
2) Jarvinen P, et al. Semin Arthritis Rheum 24(1): 19-28, 1994
3) Okada Y, et al. Nature 506(7488): 376-381, 2014
4) Wouters F, et al. Ann Rheum Dis 81(1): 48-51, 2022
5) Ueda H, et al. Nature 423(6939): 506-511, 2003
6) Ferreira RC, et al. PLoS Genet 9(4): e1003444, 2013
7) van de Stadt LA, et al. Arthritis Rheum 63(11): 3226-3233, 2011
8) Hensvold AH, et al. Annrheumdis-2013-203947, 2013
9) Terao C, et al. Mod Rheumatol 26(5): 685-689, 2016
10) Wegener N, et al. Arthritis Rheum 62:2662-2672, 2010
11) Arnett FC, et al. Arthritis Rheum 31:315-324, 1988
12) Aletaha D, et al. Ann Rheum Dis 69:1580-1588, 2010
13)関節リウマチ診療ガイドライン 編集 一般社団法人日本リウマチ学会 診断と治療社 2020



