【研究発表】膵がん細胞を標的とした新しい抗がん治療法の開発に成功
【研究発表】膵がん細胞を標的とした新しい抗がん治療法の開発に成功(医学部内科学第四講座 加藤教授・滝本講師ら研究グループ)
【研究概要】
札幌医科大学医学部内科学第四講座の加藤淳二教授と瀧本理修講師のグループは,膵がんの新たな治療法の開発に成功しました。この研究は文部科学省・科学研究費補助金ならびに国際医学振興財団などの支援のもとで行われたもので、その研究成果は国際科学誌PLoS ONE(プロスワン)に、米国時間2012年7月11日午後5時、オンライン版で発表されました。
【研究のポイント】
- 膵がんは浸潤性が高く,早期に転移を来しやすく難治がんのひとつで,現在,抗がん剤,分子標的薬が開発され臨床的に用いられていますが効果は不十分です.
- 膵がんの診断に用いられている腫瘍マーカーのCA19-9は,糖鎖であるフコースの修飾により合成されます.つまり,膵がんではフコースの需要が亢進していると考えられます.
- 本研究では,フコースを表面に結合したリポソームに抗がん剤を搭載し,膵がん細胞特異的に薬剤を送達する治療法を開発しました.本治療は,膵がん細胞の生物学的特性を狙ったもので,他にはない斬新なアイディアに基づくものです.
- フコース修飾リポソームは種々の抗がん剤を搭載することが可能であり,フコース要求度の亢進しているCA19-9産生各種がん治療への応用が可能です.
【研究の背景】
膵癌は,現在本邦における癌死亡原因の第5位に位置し,年間約22,000人を超える死亡数が推計されており,年々増加の一途を辿っています.膵がんは浸潤性が高く,早期に転移しやすいことから手術不能例が多く,極めて予後不良な癌の一つであります.
現状では,このような進行膵がんに対する有効ながん薬物療法や分子標的療法はなく,満足すべき成果は得られていません.このような背景から,当教室では膵がん細胞を標的とした新たな細胞標的療法を考案しました.
本研究では,膵がんの診断に用いられている腫瘍マーカーCA19-9に着目しました.即ち,CA19-9の合成に必須な糖鎖であるフコースが膵がん細胞へ特異的に取り込まれることを利用し,抗がん剤を搭載しフコースで修飾したリポソームを作製することで膵がん細胞へ特異的に薬剤を送達するシステムを開発しました(図1,2).
この製剤は膵がん細胞を移植した担がんマウスにおいてがん細胞特異的に取り込まれ(図3),高い抗腫瘍効果をもたらしました(図4).
現状では,このような進行膵がんに対する有効ながん薬物療法や分子標的療法はなく,満足すべき成果は得られていません.このような背景から,当教室では膵がん細胞を標的とした新たな細胞標的療法を考案しました.
本研究では,膵がんの診断に用いられている腫瘍マーカーCA19-9に着目しました.即ち,CA19-9の合成に必須な糖鎖であるフコースが膵がん細胞へ特異的に取り込まれることを利用し,抗がん剤を搭載しフコースで修飾したリポソームを作製することで膵がん細胞へ特異的に薬剤を送達するシステムを開発しました(図1,2).
この製剤は膵がん細胞を移植した担がんマウスにおいてがん細胞特異的に取り込まれ(図3),高い抗腫瘍効果をもたらしました(図4).
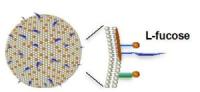
図1
図1(右) フコース結合リポソームのイメージ.
フコースはリポソームの表面に結合しており,またリポソーム表面は陰性荷電を帯び,網内系への非特異的取り込みを軽減する工夫がされています.
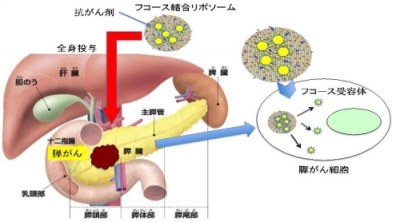
図2
図2(上) フコース結合リポソームの膵がん細胞への特異的な送達
膵がん細胞にはフコース受容体があるため,抗がん剤を搭載したフコース結合リポソームを血管内に投与しても,特異的にがん細胞に到達し,細胞内に取り込まれ抗がん剤をがん細胞のみへ送達します.従って,正常細胞への影響は極めて少なく副作用は軽微であると予想されます.また,抗がん剤はより高濃度にがん細胞へ送達されるため効果も高いことが期待されます.
膵がん細胞にはフコース受容体があるため,抗がん剤を搭載したフコース結合リポソームを血管内に投与しても,特異的にがん細胞に到達し,細胞内に取り込まれ抗がん剤をがん細胞のみへ送達します.従って,正常細胞への影響は極めて少なく副作用は軽微であると予想されます.また,抗がん剤はより高濃度にがん細胞へ送達されるため効果も高いことが期待されます.
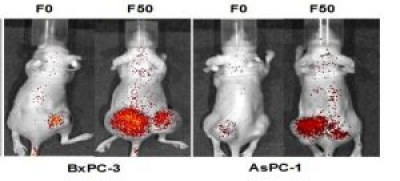
図3
図3(上) CA19-9産生膵がんへのフコース結合リポソームの集積
膵がん細胞をマウスに移植し,蛍光色素を搭載したフコース結合リポソームをマウス尾静脈より投与.F0はフコース未結合のリポソーム,F50はフコース修飾したリポソームで,フコース修飾を行うと膵がん細胞特異的に蛍光色素が集積しました.
膵がん細胞をマウスに移植し,蛍光色素を搭載したフコース結合リポソームをマウス尾静脈より投与.F0はフコース未結合のリポソーム,F50はフコース修飾したリポソームで,フコース修飾を行うと膵がん細胞特異的に蛍光色素が集積しました.
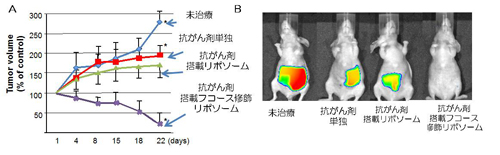
図4
図4(上) CA19-9産生膵がん移植動物モデルにおける抗がん剤搭載フコース結合リポソームの効果
A膵がん細胞をマウスに移植し,週2回薬剤を投与し,腫瘍の大きさを経時的に腫瘍体積を計測したところ,抗がん剤を搭載したフコース修飾リポソームで最も抗腫瘍効果がみられました.Bマウスの膵臓に薬剤で発色する膵がん細胞株を移植し,抗がん剤の抗腫瘍効果をin vivo image analyserで観察しました.フコース修飾リポソームでは膵がん細胞はほぼ消失していました.
A膵がん細胞をマウスに移植し,週2回薬剤を投与し,腫瘍の大きさを経時的に腫瘍体積を計測したところ,抗がん剤を搭載したフコース修飾リポソームで最も抗腫瘍効果がみられました.Bマウスの膵臓に薬剤で発色する膵がん細胞株を移植し,抗がん剤の抗腫瘍効果をin vivo image analyserで観察しました.フコース修飾リポソームでは膵がん細胞はほぼ消失していました.
【研究の意義・今後の展開】
本製剤は膵がん細胞の生物学的な特性を利用した斬新な新規治療法です.特異性が高いということは,正常細胞への影響が少ない,すなわち副作用が極めて少ないということが予想されます.
また,加えて本製剤は,膵がん治療のみならず,フコース要求度の高いCA19-9産生がん(胃がん,大腸がん,胆道がんなど)に対する治療に応用可能であり,現在実用化に向けた準備を進めています.
【論文発表の概要】
- 研究論文名:Targeting anticancer drug delivery to pancreatic cancer cells using a fucose-bound nanoparticle approach.
- 著者:Makoto Yoshida, Rishu Takimoto, Kazuyuki Murase, Yasushi Sato, Masahiro Hirakawa, Fumito Tamura, Tsutomu Sato, Satoshi Iyama, Takahiro Osuga, Koji Miyanishi, Kohichi Takada, Tsuyoshi Hayashi, Masayoshi Kobune, and Junji Kato.
- 公表雑誌:国際科学誌PLoS ONE(URL: http://dx.plos.org/10.1371/journal.pone.0039545)
- 公表日時:米国時間 2012年7月11日(水)午後5時【日本時間 7月12日(木)午前6時】