研究紹介
ページ内目次
N型糖鎖によるErbB受容体の機能制御機構
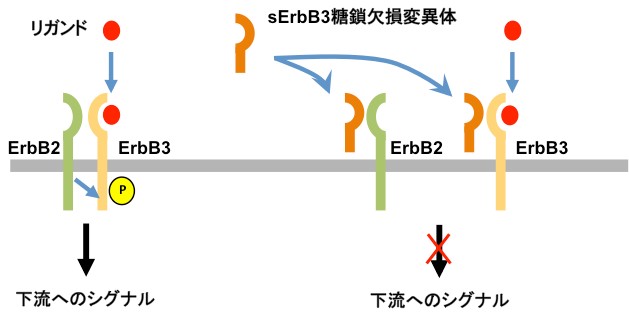
増殖因子受容体はがん治療のターゲットですが、その性質を明らかにするためには糖鎖の機能解析が不可欠です。私たちの教室ではN型糖鎖によるErbB受容体の制御機構について研究を進めてきました。ErbB受容体にはErbB1 (EGFR)、ErbB2、ErbB3、ErbB4の4つの分子がありますが、それぞれ10本前後のN型糖鎖をもっています。これまでにEGFRやErbB3の特定の糖鎖が二量体形成に関与していること、またその糖鎖を欠損したErbB3の細胞外ドメイン(可溶型ErbB3)ではシグナル抑制作用が増強することを報告しました。例えば、EGFRのN327とN337に結合する糖鎖は肺サーファクタントタンパク質Dによる増殖シグナルの制御に関与していること1)、ErbB3のN418に結合する糖鎖は、リガンド非存在下の二量体形成を阻害すること、ErbB3の細胞外ドメイン(sErbB3)のN418の糖鎖を欠損した変異体では増殖シグナル抑制作用が著しく増強すること2)(図参照)などを見出しています。以上の結果は、特定のN型糖鎖がErbBレセプターの構造変化と二量体形成を制御している可能性を示唆しています。今後、糖鎖によるErbB受容体の物性制御メカニズムを明らかにすることによって、糖鎖の生理機能の本質を理解することを目指しています。
- Takahashi M, Hasegawa Y, Ikeda Y, Wada Y, Tajiri M, Ariki S, Takamiya R, Nishitani C, Araki M, Yamaguchi Y, Taniguchi N, Kuroki Y: Suppression of heregulin β signaling by the single N-glycan deletion mutant of soluble ErbB3 protein.
J. Biol. Chem. 288, 32910-32921 (2013) - Hasegawa Y, Takahashi M, Ariki S, Asakawa D, Tajiri M, Wada Y, Yamaguchi Y, Nishitani C, Takamiya R, Saito A, Uehara Y, Hashimoto J, Kurimura Y, Takahashi H, Kuroki Y: Surfactant protein D suppresses lung cancer progression by downregulation of epidermal growth factor signaling.
Oncogene, 34, 838-845 (2015) - Takahashi M, Hasegawa Y, Gao C, Kuroki Y, Taniguchi N: N-glycans of growth factor receptors: their role in receptor function and disease implications. (review)
Clin. Sci., 130, 1781-1792 (2016)
肺コレクチンの機能解析
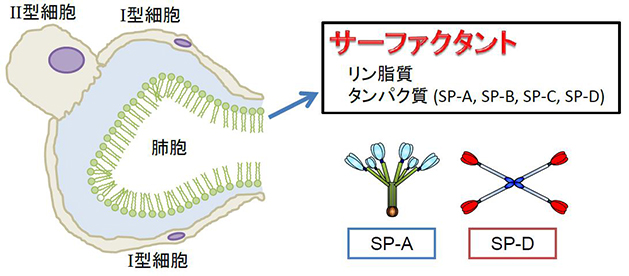
肺は常に外界と接していることから、高度な生体防御機能を備えていると考えられます。気道―肺胞の表面は、肺サーファクタントとよばれる脂質とタンパク質の複合体に覆われていますが、そのタンパク質成分には、糖認識に関わるレクチンファミリーのタンパク質が二種類 (SP-AおよびSP-D) 含まれています。これらは、その構造上の特徴から肺コレクチンとも総称されます。肺コレクチンは感染微生物の凝集や増殖抑制、炎症シグナルの調節、マクロファージの貪食促進など、様々な自然免疫機能を果たしています。私たちの研究室では、様々な感染微生物に対する肺コレクチンの生体防御機能を解析してきましたが、近年は細胞内寄生細菌 (レジオネラや非結核性抗酸菌) や、肺コレクチンの抗がん作用にも注目して研究を進めています。
また、肺コレクチンは肺以外の組織にも広く発現していることが知られていますが、これら異所性に発現している肺コレクチンの機能についても解析を進めていきたいと考えています。
- Ariki S, Kojima T, Gasa S, Saito A, Nishitani C, Takahashi M, Shimizu T, Kurimura Y, Sawada N, Fujii N, Kuroki Y: Pulmonary collectins play distinct roles in host defense against Mycobacterium avium.
J. Immunol. 187, 2586-2594 (2011) - Hashimoto J, Takahashi M, Saito A, Murata M, Kurimura Y, Nishitani C, Takamiya R, Uehara Y, Hasegawa Y, Hiyama Y, Sawada N, Takahashi S, Masumori N, Kuroki Y, Ariki S: Surfactant protein A inhibits growth and adherence of uropathogenic Escherichia coli to protect the bladder from infection.
J. Immunol. 198, 2898-2905 (2017) - Umeda Y, Hasegawa Y, Otsuka M, Ariki S, Takamiya R, Saito A, Uehara Y, Kuronuma K, Chiba H, Ohnishi H, Sakuma Y, Takahashi H, Kuroki Y, Takahashi M: Surfactant protein D inhibits activation of non-small cell lung cancer-associated mutant EGFR and affects clinical outcomes of patients.
Oncogene, 36, 6432-6445 (2017) - Takamiya R, Uchida K, Shibata T, Maeno T, Kato M, Yamaguchi Y, Ariki S, Hasegawa Y, Saito A, Miwa S, Takahashi H, Akaike T, Kuroki Y, Takahashi M: Disruption of the structural and functional features of surfactant protein A by acrolein in cigarette smoke.
Sci. Rep., 7, 8304 (2017) - Hasegawa Y, Takahashi M, Ariki S, Saito A, Uehara Y, Takamiya R, Kuronuma K, Chiba H, Sakuma Y, Takahashi H, Kuroki Y: Surfactant protein A downregulates epidermal growth factor receptor by mechanisms different from those of surfactant protein D.
J. Biol. Chem., 292, 18565-18576 (2017)
特発性肺線維症におけるマイクロバイオームの役割
特発性肺線維症(IPF)は肺内の線維化で呼吸障害を呈する慢性進行性の難病です。有効な治療法は乏しく、また病態についても不明な点が多い疾患です。我々は肺の細菌叢(マイクロバイオーム)がIPFの病態や増悪に与える影響について注目し、呼吸器・アレルギー内科学講座と共同でIPF症例の気管支肺胞洗浄液に含まれるマイクロバイオームを次世代シークエンサーを用いて解析しています。これまでに、疾患の発症・予後・増悪など臨床データと比較・検討した結果、いくつかのマイクロバイオームとIPFの病態との関連性が得られました。将来的には、バイオマーカーとしての利用や、抗菌療法・ワクチン療法などを用いたIPF治療を目指して研究を進めています。
- Takahashi Y, Saito A, Chiba H, Kuronuma K, Ikeda K, Kobayashi T, Ariki S, Takahashi M, Sasaki Y, Takahashi H: Impaired Diversity of the Lung Microbiome Predicts Progression of Idiopathic Pulmonary Fibrosis.
Respir. Res. 19:34 (2018)
臨床応用に向けた肺胞微石症の病態解析
肺胞微石症は肺胞II型上皮細胞におけるナトリウムリン酸共輸送体の遺伝子異常が原因で肺胞腔内にリン酸カルシウム結石を生ずる常染色体劣性遺伝性の希少肺疾患です1)。現在まで有効な治療法はなく、その開発が望まれています。これまでに我々は同疾患モデルマウスを作製して病態解析を行ない、低リン食治療が進行抑制・病勢の改善に寄与することを報告してきました2)。現在は、研究をさらに発展させ、低リン食治療とリン吸着剤の併用法の治療効果と副作用についての検討や、生化学的手法を用いて肺胞マクロファージの機能解析を進めて肺胞微石症の病態を分子・細胞レベルで解明することを目指しています。
- Saito A, McCormack FX: Pulmonary Alveolar Microlithiasis.
Clin. Chest Med., 37, 441-448 (2016) - Saito A, Nikolaidis NM, Amlal H, Uehara Y, Gardner JC, LaSance K, Pitstick LB, Bridges JP, Wikenheiser-Brokamp KA, McGraw DW, Woods JC, Sabbagh Y, Schiavi SC, Altinisik G, Jakopovic M, Inoue Y, McCormack FX: Modeling pulmonary alveolar microlithiasis by epithelial deletion of the Npt2b sodium phosphate cotransporter reveals putative biomarkers and strategies for treatment.
Sci. Transl. Med., 7, 313ra181 (2015)
